Гематоэнцефалический барьер (ГЭБ) — это сложная гетерогенная система головного мозга (ГМ) с несколькими уровнями избирательного транспорта, регуляции и защиты, способная поддерживать гомеостаз центральной нервной системы (ЦНС). Впервые идею о существовании разделительного барьера высказал П. Эрлих в 1885 г., доказав, что краситель трипановый синий после введения в кровь не обнаруживается в мозге. В данной публикации гематоэнцефалический барьер рассмотрен с точки зрения анестезиолога-реаниматолога. Поиск источников для данного обзора литературы проводился с использованием электронных ресурсов российской научной электронной библиотеки eLIBRARY.ru, библиографической базы статей по медицинским наукам (MEDlars onLINE) Национальной медицинской библиотеки США (U.S. National Library of Medicine, NLM), базы данных Cochrane Reviews, а также информационных ресурсов UpToDate. Глубина поиска составляла 30 лет. При отборе источников сделан акцент на данные рандомизированных контролируемых исследований и метаанализов. Найдено 88 источников, из них 3 метаанализа, включавших 728 публикаций, 38 из которых использованы для обзора и указаны в списке литературы.
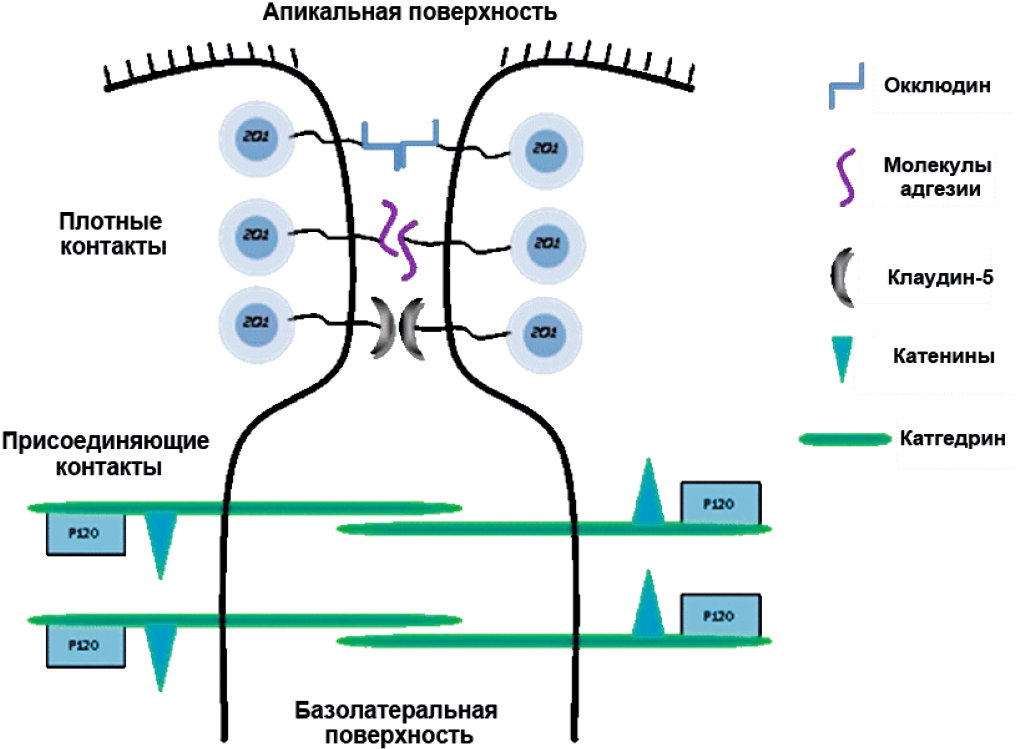
Структурные единицы, из которых складывается ГЭБ, выполняют не только защитную, но регуляторную, питательную и выделительную функцию. Основными функциональными и анатомическими элементами ГЭБ являются эндотелиоциты капилляров ГМ, астроциты, нейроны и перициты, представляющие собой «нейроваскулярную единицу» (рис. 1) [1]. Плотные контакты (ПК) являются наиболее апикальными межклеточными соединениями в эндотелиоците. Их основными трансмембранными компонентами являются клаудины, окклюдин и молекулы адгезии (JAM), тогда как их цитоплазматические компоненты являются белками zonula occludens (ZO). Присоединяющие контакты локализуются чуть ниже ПК; их трансмембранные белки — кадгерины и нектины — образуют цитоплазматические комплексы α- и β-катенин и афадин (рис. 2). Все компоненты ГЭБ находятся в тесной взаимосвязи между собой, что и обеспечивает уникальность данного биологического барьера [2, 3].
Рис. 1. Нейроваскулярная единица. Адаптировано из [1]
Fig. 1. The most important cellular elements of blood-brain barrier [1]
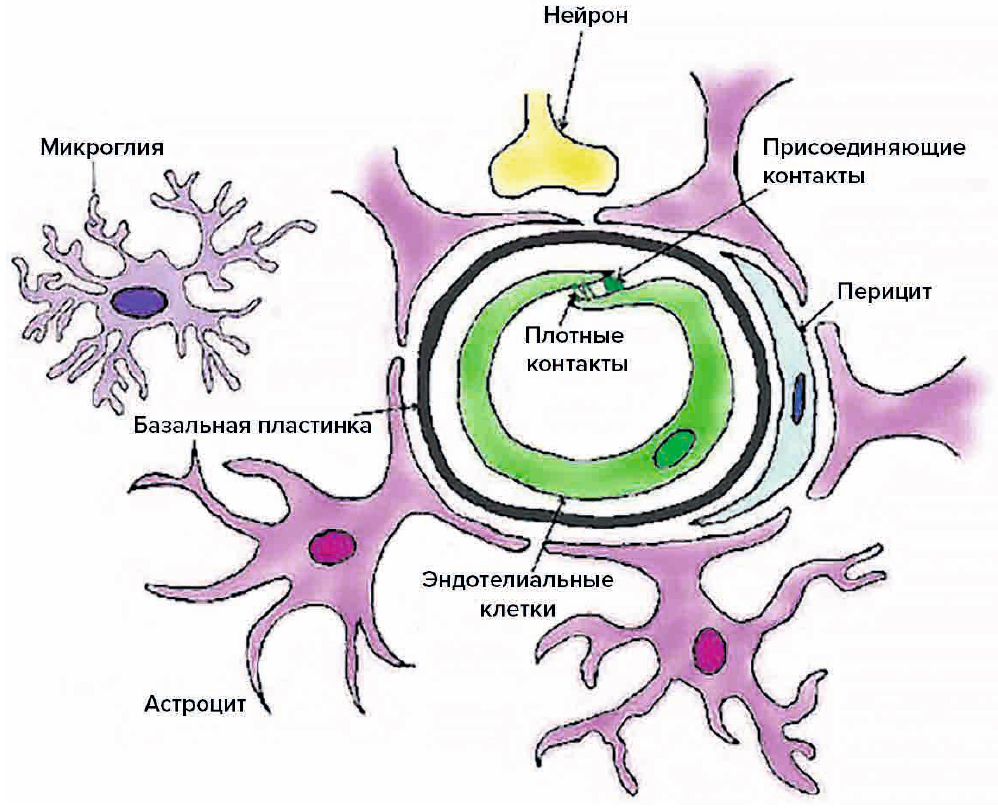
Рис. 2. Схематическое изображение белков, которые участвуют в формировании плотных и присоединяющих контактов в эндотелиальных клетках микрососудов головного мозга. Адаптировано из [1]
Fig. 2. Schematic representation of proteins that are involved in the formation of the tight junction and adherens junctions in brain microvessel endothelial cells [1]
ГЭБ выполняет метаболическую, транспортную, иммунную и нейросекреторную функции, без которых невозможно нормальное функционирование ЦНС [4]. Высокая проницаемость ГЭБ для СО2 и его относительная непроницаемость для Н+ и НСО– создает возможность существования особого механизма регуляции кровотока в головном мозге и вентиляции легких. Так, хотя главным детерминатом обеих этих физиологических функций является РСО2 артериальной крови, в действительности чувствительные клетки реагируют на рН интерстициальной жидкости ГМ. Для обеспечения своих энергетических потребностей мозг нуждается в некоторых гидрофильных веществах, например, в глюкозе и аминокислотах, для доставки которых существуют транспортные системы со специфическими белками — переносчиками [5].
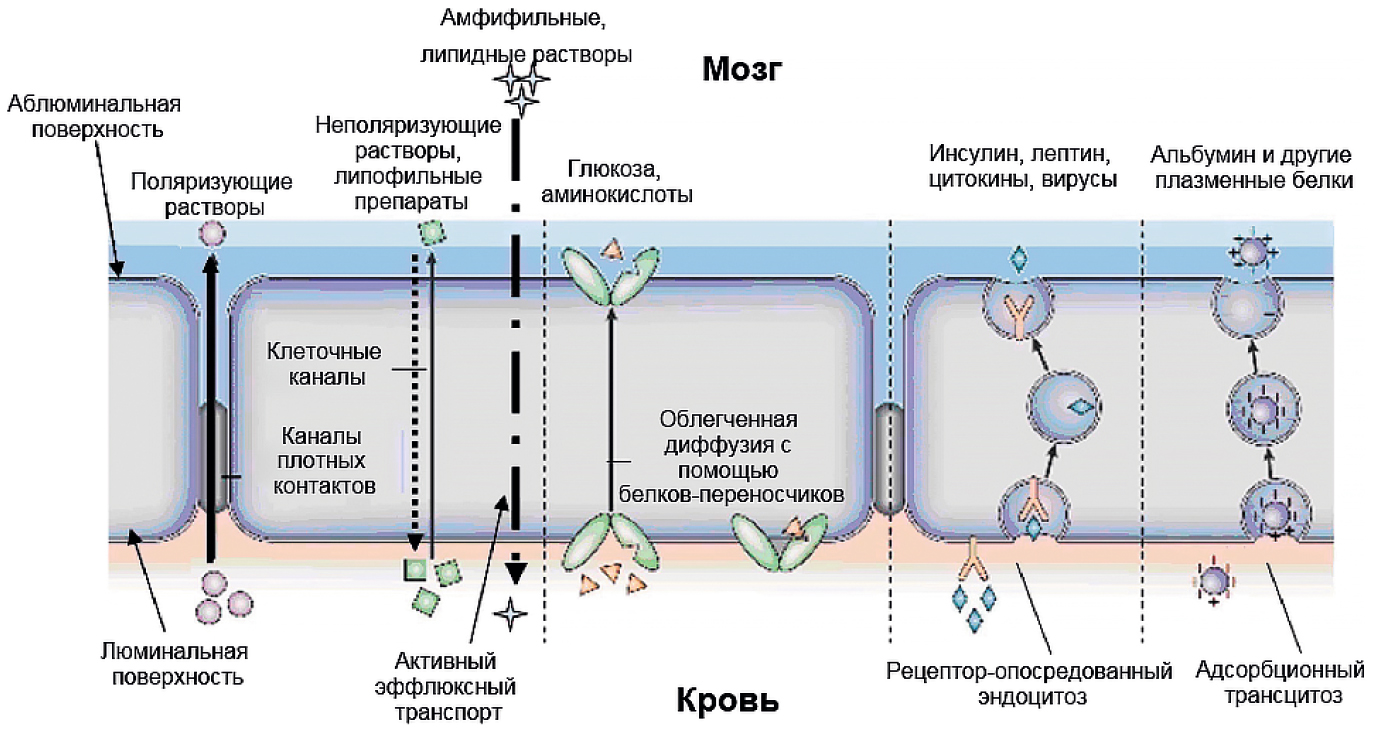
Трансцеллюлярный транспорт биологически активных веществ через ГЭБ может осуществляться следующими путями (рис. 3) [6, 7]:
- простая диффузия в направлении градиента концентраций. Необходимым условием для нее является высокая липофильность вещества. Так, быстро проникают через ГЭБ неорганические молекулы O2, CO2, H2O;
- облегченная диффузия, опосредованная переносчиком, в направлении градиента концентраций. Молекулы, самостоятельно не способные проникнуть через мембрану, связываются с белками-переносчиками и транспортируются посредством эндоцитоза (аминокислоты, нуклеотиды, глутатион, пептиды малого размера);
- эндоцитоз — движение молекул и ионов через клеточную мембрану против любого из градиентов (электрохимических, осмотических и т. д.) с использованием энергии АТФ (трансферрин, лептин, инсулин, белок gp120);
- эффлюксный транспорт — передвижение в направлении «мозг — кровь». В последние годы исследованиям данного пути трансцеллюлярного транспорта стало уделяться гораздо больше внимания. Возможность оказывать влияние на эффлюкс может помочь в разработке новых лекарственных препаратов и методов их доставки. Липофильные вещества покидают мозг через ГЭБ путем простой диффузии. Наиболее важным транспортным эффлюксным механизмом, являющимся главной помехой для действия многих фармакологических агентов, считается опосредованное переносчиком выделение. В его основе лежат так называемые транспортеры ABC (ATP-Binding Cassette), связанные с АТФ: белки неспецифической лекарственной устойчивости (multidrug-resistance proteins, MDR), P-гликопротеин (P-gp); белок устойчивости к раку молочной железы (breast cancer resistance protein, BCRP).
Рис. 3. Возможные механизмы транспорта через гематоэнцефалический барьер. Адаптировано из [5]
Fig. 3. Potential transport mechanisms across the blood-brain barrier [5]
Эти белки играют ключевую роль в функционировании активного выведения разнообразных биологических агентов из ЦНС. Их физиологическая роль заключается в экспорте из нейронов метаболитов, нейротоксинов (ксенобиотиков) и избыточного количества нутриентов.
Третьим эффлюксным механизмом является конвективно-опосредованное выделение, когда вещество минует прохождение через биологические мембраны. На сегодняшний день многие его аспекты остаются неизученными [7].
Избирательность транспортных систем ГЭБ позволяет предотвратить воздействие некоторых медиаторов на ЦНС. Например, через ГЭБ не может проходить глутаминовая кислота, повышенное выделение которой наблюдается при инсульте. Проницаемость ГЭБ зависит от возраста человека: она очень высока в первые недели жизни ребенка и очень мала в старости. Это обусловливает частоту возникновения и тяжесть протекания определенных заболеваний, а также протекание определенных биохимических процессов: у детей чаще возникают инфекционные заболевания мозга и его оболочек (менингит, энцефалит), а болезнь Альцгеймера характерна для людей пожилого возраста [8]. Важно отметить, что ГЭБ не статичен, а скорее динамичен, взаимодействует с микросредой и отвечает потребностям ЦНС. Его проницаемость частично контролируется внутри- и межклеточной передачей сигналов между эндотелиальными клетками и окружающими астроцитами и нейронами. Конкретные транспортеры позволяют необходимым водорастворимым молекулам, таким как глюкоза, быстро проходить ГЭБ и опосредовать транспорт больших молекул (например, некоторых белков) [9].
Общий белок в ликворе (ОБЛ) — один из самых чувствительных индикаторов патологии ЦНС. Альбумины легко проходят через ГЭБ, тогда как поступление крупных белковых молекул, например иммуноглобулинов, существенно затруднено. ОБЛ составляет всего лишь 0,1–0,2 % количества белка крови, и в норме основной белок СМЖ — альбумин (35–80 %). Повышение концентрации ОБЛ наблюдается в следующих ситуациях.
- Увеличение проницаемости ГЭБ служит причиной изменений концентрации ОБЛ при многих инфекционно-воспалительных заболеваниях. В этом случае изменение белковых фракций в ликворе отражает изменения белкового состава крови. Концентрация ОБЛ более 1,5 г/л может служить специфическим признаком бактериального менингита. При вирусных энцефалитах и менингоэнцефалитах концентрация ОБЛ в ликворе обычно менее 0,95 г/л. Повышение ОБЛ наблюдается при субарахноидальном кровоизлиянии, церебральных васкулитах и злокачественных новообразованиях ГМ.
- Усиленный синтез белка и его выделение в ликвор (при рассеянном склерозе, саркоидозе, нейросифилисе).
- Нарушение резорбции ОБЛ через пахионовы грануляции.
Для определения степени прорыва ГЭБ предложены различные расчетные формулы, простейшей из которых является расчет альбуминового индекса: (альбумин СМЖ / альбумин крови) х 100 [10]. В норме он не должен превышать 9 единиц. При выраженных повреждениях ГЭБ он составляет от 30 до 100 единиц. Есть данные, что у больных с тяжелой черепно-мозговой травмой индекс может достигать 80–100 ед.
ГЭБ отсутствует в шести анатомических образованиях:
- area postrema ромбовидной ямки (дна IV желудочка);
- шишковидное тело (эпифиз);
- нейрогипофиз;
- прикрепленная пластинка (lamina affixa);
- субфорникальный орган;
- субкомиссуральный орган (СКО).
Большинство из них — нейроэндокринные структуры, участвующие в процессах нейрогуморальной регуляции. Наличие ГЭБ препятствовало бы исполнению данными анатомическими образованиями своих функций [7].
В ЦНС существует несколько барьерных образований с характерными структурно-функциональными особенностями. К ним относятся собственно гематоэнцефалический (или гематонейрональный), гематоликворный (ГЛБ) и ликвороэнцефалический (или нейроликворный) барьеры (рис. 4) [6]. Благодаря их существованию головной мозг в значительной степени изолирован от клеток иммунной системы, циркулирующих в крови [8].
Рис. 4. Взаимосвязь гематоликворного и гематоэнцефалического барьера. Адаптировано из [5]
Fig. 4. Overview of the blood-brain barrier and blood-cerebrospinal fluid barrier [5]
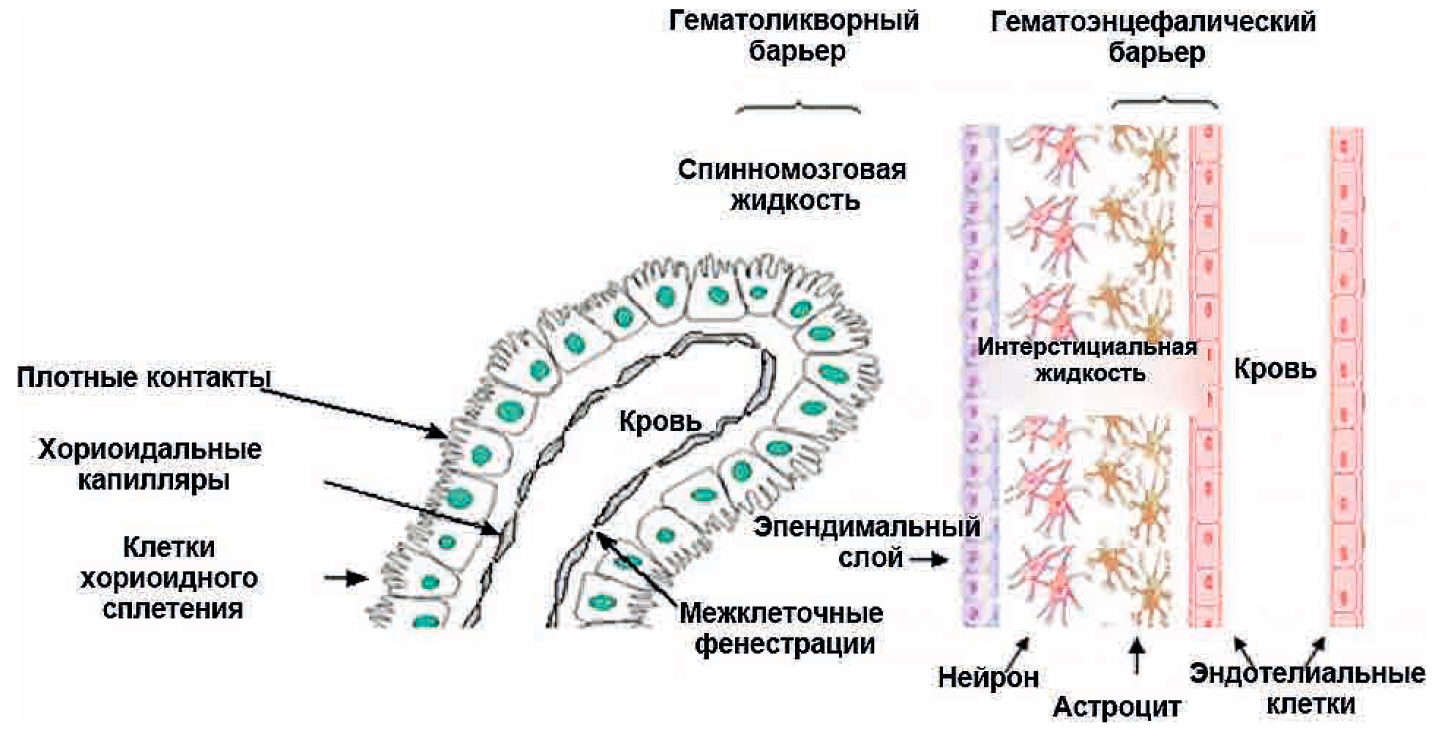
Площадь ГЛБ составляет 1/5000 общей площади ГЭБ [5]. Он образован эпителиальными клетками, выстилающими сосудистое сплетение желудочков мозга. Так как поверхность ГЛБ почти в 5000 раз меньше площади ГЭБ, вклад ГЛБ в поддержании гомеостаза мозга невелик.
Внутричерепное-интраспинальное пространство (intracranial-intraspinal space) состоит из нескольких отделов, или компартментов. Даже в отдельных областях одного компартмента, например спинномозговой жидкости (СМЖ), существуют сильные различия в концентрациях лекарственного средства (ЛС) между желудочковым, цистернальным и поясничным отсеками. Таким образом, внутричерепное пространство и позвоночный канал нельзя рассматривать как единый физиологический компартмент: он разделен на пространство СМЖ, внеклеточные и внутриклеточные пространства головного и спинного мозга (рис. 5) [11].
Рис. 5. Внутричерепные жидкостные компартменты. Непрерывные стрелки представляют направление потока спинномозговой жидкости (СМЖ). Прерванные стрелки указывают, где может произойти диффузия воды или растворенных веществ между мозговыми капиллярами, ликвором и нервной тканью: a — через гематоэнцефалический барьер; b — через эпителий сосудистого сплетения; c — через эпендиму; d — через пиа-глиальные мембраны на поверхности головного и спинного мозга; е, f — через клеточные мембраны нейронов и глиальных клеток. Толстая линия представляет твердую мозговую оболочку (ТМО) и паутинную оболочку. Адаптировано из [12]
Fig. 5. Intracranial fluid compartments. Continuous arrows represent the direction of the cerebral spinal fluid flow. Interrupted arrows indicate where a diffusion of water or solutes can occur between brain capillaries, CSF, and nervous tissue: a — across the blood-brain barrier; b — across the epithelium of the choroid plexus; c — across the ependyma; d — across the pia-glial membranes at the surface of the brain and spinal cord; e, f — across the cell membranes of neurons and glial cells. The thick line represents the dura mater and arachnoidea surrounding the system [12]
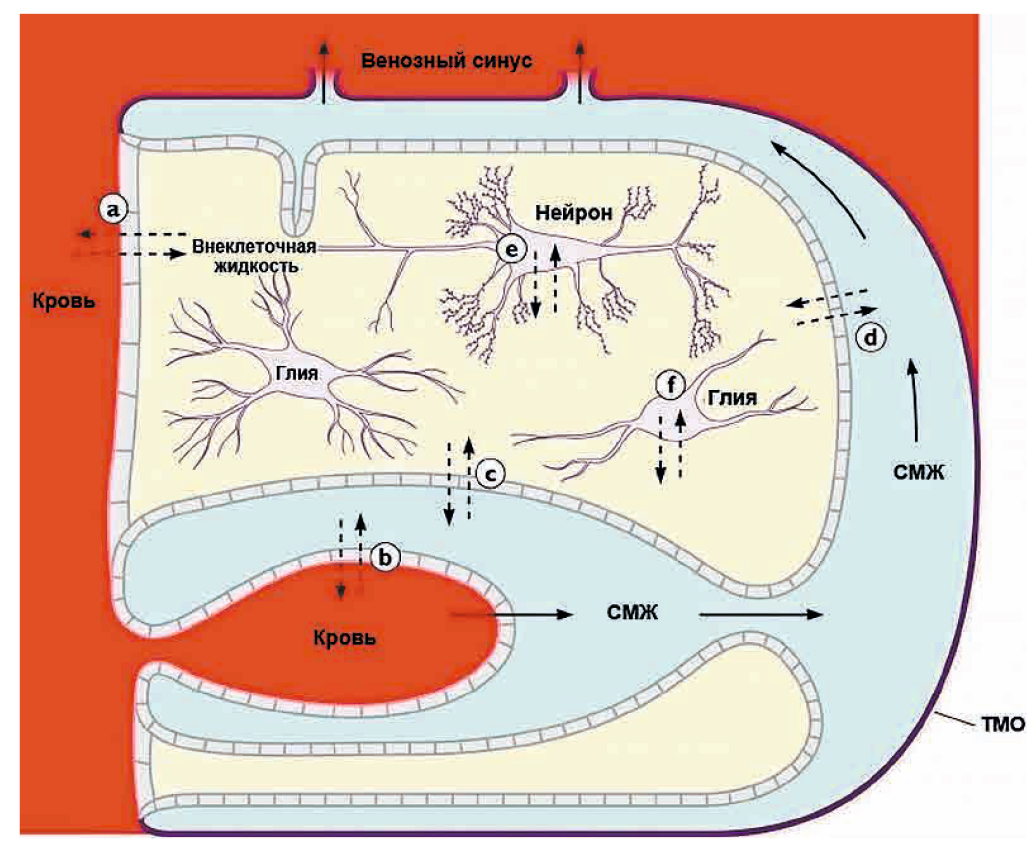
При внутривенном введении большинство ЛС достигает более высоких концентраций в поясничном, а не в желудочковом компартменте СМЖ. В настоящее время для многих соединений неизвестно, как именно после системного введения концентрация ЛС в интерстициальном пространстве мозга коррелирует с концентрацией в СМЖ.
Когда на продукцию и абсорбцию СМЖ не оказывают серьезного влияния неблагоприятные факторы, средний объем ликвора составляет 20–30 мл/ч. На скорость влияют возраст, церебральное перфузионное давление и некоторые ЛС, например, диуретики. Для большинства противоинфекционных препаратов концентрация в СМЖ существенно ниже, чем в плазме. Соотношение клиренса поступления–выведения для лекарственного средства определяется соотношением его «площади под фармакокинетической кривой (концентрация–время)» (AUC) в CМЖ и в плазме крови (пл) после внутривенного введения:
CL in / CL out = AUC СМЖ / AUC пл.
Для людей отношение AUC СМЖ / AUC пл является наиболее точным параметром для характеристики проникновения препарата в СМЖ [11]. Данный показатель положительно коррелирует с липофильностью препарата (logP) и отрицательно — с его молекулярной массой [12].
Фармакокинетические данные о поступлении многих лекарств во внутричерепные компартменты являются неполными. По этой причине необходимо иметь представление о физико-химических свойствах препаратов, которые помогут оценить, какие соединения наиболее перспективны для лечения инфекций ЦНС.
Проникновение лекарственных препаратов в ЦНС в отсутствие воспаления. Поступление лекарств, в том числе антибиотиков, в СМЖ и внеклеточное пространство мозга регулируется следующими факторами.
Молекулярная масса (ММ). Молекулы с массой более 500 г/моль обычно не могут свободно проникать через ГЭБ. Хотя проникновение крупных гидрофильных соединений в СМЖ низкое, молекулы размера IgM присутствуют в нормальном ликворе приблизительно в 1/1000 от их концентрации в плазме крови.
Липофильность соединения увеличивает его способность проникать через липидный бислой мембран клеток. Значение коэффициента липофильности определяется с помощью стандартной системы «октанол — вода» при pH 7,0. Логарифм коэффициента липофильности обозначается как log PO/W.
Связывание с белками плазмы. При наличии неповрежденного ГЭБ свободно может проникать только несвязанная фракция плазмы, поскольку связывающие белки (в частности, альбумин и глобулины) проходят через ГЭБ/ГЛБ лишь в небольшой степени. В сравнительном исследовании на людях проникновение в СМЖ цефтриаксона (связывание с белками плазмы от 90 до 95 %) было на 1 порядок ниже, чем у цефотаксима (связывание с белками < 40 %). В настоящее время ставится под сомнение идея о том, что только свободная фракция препарата оказывает терапевтическое действие [13]. Доказано, что у некоторых АБП доступность для транспорта в ЦНС зависит от фракции препарата, связанной с глобулинами. Из-за низких концентраций ОБЛ связывание антибактериальных средств с белками СМЖ обычно игнорировалось. Однако в случае препаратов с высоким сродством к сывороточным белкам это упрощение недопустимо [11, 12].
На основании молекулярного размера, липофильности и связывания с белками плазмы можно оценить проникновение ЛС в СМЖ (табл. 1).
Таблица 1. Физико-химические свойства препаратов, определяющие проницаемость через ГЭБ (в отсутствие воспаления) [10, 12]
Table 1. Physicochemical properties of drugs that determine the permeability through the BBB (in the absence of inflammation) [10, 12]
Препарат
Молекулярная масса, g/mol
Липофильность, log PO/W
Связь с белками плазмы крови, %
Концентрация препарата в спинномозговой жидкости в соотношении с его концентрацией в плазме крови (AUCСМЖ / AUCпл), %
Антибактериальные
Пенициллины
Бензилпенициллин
Амоксициллин
Ампициллин
334
365
349
1,667 ± 0,197
0,614 ± 0,330
1,350 ± 0,320
40–60
17
20
5–10
10
10
Цефалоспорины
Цефотаксим
Цефтриаксон
Цефтазидим
Цефепим
455
555
547
481
1,196 ± 0,888
–0,249 ± 1,124
–1,21
–0,36
30–50
83–96
< 15
< 20
20
10
10
20
Карбапенемы
Имипенем + [Циластатин]
Меропенем
299
383
–2,784 ± 0,760
–3,132 ± 0,750
20
< 2
20
30
Аминогликозиды
Гентамицин
Амикацин
478
586
–1,64
–3,343 ± 0,924
< 10
4–11
10
10
Фторхинолоны
Ципрофлоксацин
Левофлоксацин
Моксифлоксацин
331
361
401
1,313 ± 0,785
1,607 ± 0,814
1,896 ± 0,820
20–40
30–40
39–48
40
80
80
Макролиды
Азитромицин
Кларитромицин
749
748
3,329 ± 0,766
3,159 ± 0,780
7–50
65–75
–
–
Колистиметат натрия
1155
–1,28
< 10
5–25
Линезолид
337
0,432 ± 0,731
31
90
Метронидазол
171
–0,013 ± 0,298
10–20
80
Ванкомицин
1449
–1,439 ± 1,021
55
20
Рифампицин
823
1,086 ± 0,743
84–91
20
Противовирусные
Ацикловир
Фоскарнет натрия
Зидовудин
225
126
267
–1,760 ± 0,489
–1,63
1,15
9–33
14–17
30–38
20
20–30
75
Противогрибковые
Флуконазол
Амфотерицин B
306
924
0,500 ± 0,887
1,210 ± 0,855
11–12
> 90
80
< 10
Проникновение лекарственных препаратов в ЦНС в условиях воспаления. При бактериальном менингите ГЭБ/ГЛБ становятся проницаемыми из-за открытия межклеточных плотных соединений стенок сосудов, особенно в венулах. Также увеличивается сопротивление оттоку СМЖ, что приводит к умеренному снижению скорости ее продуцирования и абсорбции. Активность P-gp также может ингибироваться провоспалительными цитокинами. В условиях серьезного нарушения ГЭБ физико-химические свойства ЛС, регулирующие их поступление в ЦНС в отсутствие менингеального воспаления, становятся менее важными [13, 15].
Особенности проникновения через ГЭБ/ГЛБ антибактериальных препаратов
β-лактамные антибиотики характеризуются высоким уровнем активности в отношении восприимчивых патогенов и относительно низкой токсичностью. Суточная доза β-лактамов может быть существенно увеличена без высокой частоты серьезных побочных эффектов. Например, в исследовании Viladrich с соавт. (1996) для лечения менингита, вызванного пневмококками со сниженной чувствительностью к цефалоспоринам, суточная доза цефотаксима достигала 24 г, при этом авторами отмечена хорошая переносимость препарата [16]. β-лактамные антибиотики могут вызывать эпилептические приступы после интратекального и внутривенного введения. В исследовании Wong с соавт. (1991) эпилептические припадки наблюдались у 33 % детей с бактериальным менингитом, получавших имипенем+[циластатин] внутривенно [17]. При внутрижелудочковом введении у крыс цефазолин, имипенем+[циластатин] и азтреонам доказанно индуцировали эпилептические приступы [18]. По этой причине для терапии инфекций ЦНС вместо имипенема+[циластатина] рекомендуется использовать меропенем. В Европе и США не показано внутрижелудочковое введение β-лактамных антибиотиков, так как в ряде случаев необходимо существенное увеличение дозы для обеспечения более высоких концентраций в СМЖ, а также из-за их проконвульсивной активности. Для новых карбапенемов — дорипенема и эртапенема — данные о проникновении в ЦНС у человека отсутствуют.
Аминогликозиды представляют собой гидрофильные соединения с ММ около 400 Да и низким связыванием с белками плазмы. Считается, что из системного кровотока в СМЖ антибиотики данной группы не проникают. Из-за нефро- и ототоксичности суточная доза аминогликозидов может быть увеличена только в узких пределах, что препятствует достижению эффективных концентраций в СМЖ, особенно в условиях слабого и умеренного воспаления. Но несмотря на серьезные побочные эффекты, накоплен большой опыт интравентрикулярного введения аминогликозидов.
Большинство фторхинолонов являются умеренно липофильными лекарственными средствами с ММ около 300 Да и низким связыванием с белками плазмы (от 20 до 40 %). Их проникновение в СМЖ при отсутствии воспаления значительно выше, чем у β-лактамных антибиотиков. Активность большинства фторхинолонов слишком низка для лечения менингита, ассоциированного со Streptococcus pneumoniae, однако их системное введение успешно применяется для лечения инфекций ЦНС, вызванных грамотрицательными аэробными бактериями (ципрофлоксацин) и микобактериями туберкулеза (моксифлоксацин). Из-за их относительно высокой токсичности для ЦНС существенное увеличение их системной дозы невозможно. Поскольку фторхинолоны легко проникают в ЦНС из плазмы крови, нет необходимости в их интратекальном введении.
Макролиды хорошо проникают в ткани, но из-за их относительно высокой ММ (около 750 Да) и, вероятно, из-за их сродства к P-гликопротеину, они не достигают достаточных концентраций в СМЖ в отсутствие менингеального воспаления. Из-за недостаточной бактерицидной активности в отношении S. Pneumoniae их роль в лечении инфекций ЦНС ограничена энцефалитами и менингитами, ассоциированными с Mycoplasma sp. и Legionella pneumophila.
Тетрациклины. Липофильный препарат доксициклин легко всасывается после перорального применения. Его связывание с белками составляет > 80 %, а период его полувыведения — от 12 до 25 ч. В небольших исследованиях доксициклин не уступал по эффективности цефтриаксону в лечении нейроборрелиоза. Является частью стандартных протоколов лечения нейробруцеллеза и нейросифилиса.
Линезолид, первый оксазолидинон, который активен в отношении грамположительных бактерий, обладает амфифильными свойствами и легко проникает в СМЖ. Несмотря на то что препарат в основном обладает бактериостатическими свойствами, линезолид успешно применяется для лечения инфекций ЦНС, вызванных мультирезистентными организмами.
Метронидазол — небольшое липофильное соединение, эффективное против анаэробных бактерий, хорошо проникает в большинство тканей, включая содержимое абсцесса. В исследованиях на животных и людях метронидазол легко проникал через ГЭБ/ГЛБ. Является частью стандартной терапии бактериального абсцесса мозга.
Гликопептиды — гидрофильные антибиотики с высокой молекулярной массой (более 1400 Да). Хотя токсичность не так велика, как у аминогликозидов, она достаточно высока для того, чтобы ограничить увеличение дозы. Для пациентов с воспаленными мозговыми оболочками при высоких внутривенных дозах достигаются бактерицидные концентрации ванкомицина в СМЖ против чувствительных патогенов [19].
Полипептиды состоят из крупных гидрофильных соединений с высокой системной токсичностью. Колистиметат натрия используется у детей и взрослых для элиминации устойчивого к карбапенемам Acinetobacter sp. Как при отсутствии, так и при наличии воспаления менингеальных оболочек, проникновение колистиметата натрия в СМЖ из системного кровотока недостаточное. Поскольку относительно высокая токсичность не позволяет увеличить системную суточную дозу, колистиметат натрия часто вводят интратекально. Однако до настоящего времени фармакокинетика препарата после внутрижелудочкового введения не исследована.
Самый простой способ увеличить концентрацию препарата в ЦНС — увеличить системную дозу. Некоторые АБП обладают низкой токсичностью. Следовательно, суточная доза может быть увеличена без серьезных побочных эффектов: так, для экстрацеребральных инфекций стандартная доза меропенема составляет три дозы по 1 г в сутки, тогда как для менингита (у взрослых) — три дозы по 2 г в сутки. Менингит, ассоциированный с Acinetobacter baumannii, успешно лечили 2 г ампициллина и 1 г сульбактама каждые 3 ч без серьезных побочных эффектов [20]. Суточная доза флюконазола может быть увеличена до 1600 мг с переносимыми побочными эффектами [21].
Эффективным, но инвазивным методом для достижения высоких концентраций в ЦНС является интратекальное введение АБП в дополнение к внутривенному. Термин «интратекальное введение» (от лат. teka — оболочка) означает доставку вещества в подоболочечное пространство, т. е. субарахноидально после прокола твердой мозговой оболочки. Значимыми преимуществами интратекального пути введения являются возможность получения максимальных концентраций ЛС в ткани мозга и СМЖ, а также введение АБП, не проникающих через ГЭБ. Препараты, вводимые интратекально, не должны содержать консервантов. Инъекции должны выполняться медленно, небольшим объемом, чтобы избежать повышения внутричерепного давления у пациентов с нарушенным оттоком СМЖ [11]. При введении через вентрикулярный дренаж необходима экспозиция в течение 15–60 мин.
Основным показанием для эндолюмбального введения антибиотиков в СМЖ является бактериальный менингит (при отсутствии клинического и лабораторного улучшения состояния больного в течение 72 ч после начала парентерального введения АБП). Показаниями для этого вида лечения также являются вентрикулит, позднее начало лечения и рецидив менингита [22]. В детской практике показаниями для интратекального введения антибиотиков в первые 3 дня являются выраженные изменения СМЖ (цитоз 20 000–30 000 ×106/л, высокий уровень белка), отсутствие положительной динамики. Интратекально вводят гентамицин 1мг/кг и ванкомицин 4–10 мг/сут в 1–2 мл 0,9% раствора NaCl.
Этот метод также показан при использовании АБП с низким проникновением в СМЖ и/или высокой токсичностью, что исключает увеличение системной дозы (например, аминогликозиды, ванкомицин, амфотерицин В, полимиксины). Ванкомицин и другие препараты с большой ММ и гидрофильностью имеют длительный период полувыведения из СМЖ, что обеспечивает достижение терапевтической концентрации при однократном интратекальном введении в течение суток [11].
Не существует АБП, одобренных FDA (US Food and Drug Administration) для внутрижелудочкового введения, а также до сих пор не определены четкие показания для их интратекального использования. Антимикробные дозы определены опытным путем на основе способности АБП достигать адекватных концентраций в СМЖ (табл. 2) [19].
Таблица 2. Интравентрикулярное применение антибиотиков для достижения эффективных концентраций в центральной нервной системе [23, 24]
Table 2. Intraventricular administration of antibiotics to achieve effective concentrations in the central nervous system [23, 24]
Антибиотик
Дозировка
Серьезный зарегистрированный побочный эффект
Гентамицин
1–8 мг каждые 24 ч
Обычная суточная доза составляет 1–2 мг для младенцев и детей и 4–8 мг для взрослых
Потеря слуха (временная), эпилептические припадки, асептический менингит, эозинофильный плеоцитоз СМЖ
Тобрамицин
5–20 мг каждые 24 ч
См. Гентамицин
Амикацин
5–50 мг каждые 24 ч
(обычная суточная доза составляет 30 мг)
См. Гентамицин
Стрептомицин
До 1 мг/кг каждые (24–48 ч)
Потеря слуха (временная), эпилептические припадки, радикулит, поперечный миелит, арахноидит, параплегия
Ванкомицин
5–20 мг каждые 24 ч
Потеря слуха (временная)
Полимиксин В
5 мг каждые 24 ч
Дозировка у детей составляет 2 мг в сутки
Менингеальное асептическое воспаление
Колистиметат натрия (полимиксин Е) метансульфонат (12500 МЕ = 1 мг)
10 (1,6–20) мг каждые 24 ч
Менингеальное воспаление; при применении высоких доз — эпилептические припадки, потеря аппетита, возбуждение, альбуминурия
Даптомицин
5–10 мг каждые 72 ч
Высокая температура
Амфотерицин В
0,1–0,5 мг каждые 24 ч
Звон в ушах, лихорадка, дрожь, синдром Паркинсона
В настоящее время в Российской Федерации отсутствуют клинические рекомендации по диагностике и лечению бактериального гнойного менингита у взрослых, однако в 2013 г. были утверждены Федеральные рекомендации по диагностике и лечению бактериальных менингитов у детей [25]. В клинической практике иногда руководствуются рекомендациями Американского общества по инфекционным болезням (IDSA) по диагностике и лечению менингитов и вентрикулитов, а также рекомендациями Европейского общества по микробиологии и инфекционным заболеваниям [26–28]. Отечественные рекомендации НИИ нейрохирургии им. акад. Н.Н. Бурденко и НИИ скорой помощи им. Н.В. Склифосовского по лечению тяжелой черепно-мозговой травмы включают в себя раздел «профилактики и лечения внутричерепных гнойных осложнений». Так, в 2014 г. внутрижелудочковое введение АБП предлагалось осуществлять нейрохирургам с кратностью 2–6 раз в сутки. Интратекальное введение, наряду с парентеральным, считалось основным методом введения антибиотика при развитии гнойных осложнений. В зависимости от результатов посева ликвора предпочтительными АБП были названы ванкомицин в разовой дозе 5 мг (суточная доза 10 мг), амикацин в разовой дозе 100 мг (суточная доза 300 мг), меронем в разовой дозе 10 мг (суточная доза 40 мг) [29]. В рекомендациях НИИ нейрохирургии им. акад. Н.Н. Бурденко и НИИ скорой помощи им. Н.В. Склифосовского по лечению тяжелой черепно-мозговой травмы от 2016 г. уточнено, что интратекальное введение АБП допустимо лишь в особых случаях при тяжелом течении менингита и отсутствии противопоказаний. Рекомендуется использование специально адаптированных к интратекальному введению солей антибиотиков: ванкомицин (10–20 мг/сут), гентамицин (4–8 мг/сут), тобрамицин (5–20 мг/сут), амикацин (5–30 мг/сут), полимиксин В (5 мг/сут), колистин (10 мг/сут) [23].
Усложняет создание единого алгоритма к интратекальному использованию антибиотиков и то, что в официальных инструкциях по их применению данный метод введения практически не представлен, а АБП, рекомендуемые для лечения менингитов, не охарактеризованы с точки зрения переносимости при введении в ликворопроводящее пространство. Прямых противопоказаний к интратекальному пути введения АБП нет, однако возможность токсического воздействия на ЦНС значительно сузила спектр используемых лекарственных средств [22].
До настоящего времени продолжаются исследования эффективности и безопасности интратекального использования АМП. Khan с соавт. (2017) показали, что сочетание внутривенного и интратекального способов введения АБП при грамотрицательном менингите ускоряет санацию ликвора и практически исключает рецидивы [30]. Brian с соавт. (2016) описали успешный случай лечения бактериального менингита с использованием линезолида в дозировке 10 мг/сут (концентрация — 2 мг/мл) [31]. В исследовании Wang с соавт. (2017) показано, что цефтриаксон и ванкомицин обладают хорошей клинической эффективностью при лечении нейроинфекций [32]. Mader с соавт. (2018) утверждают, что проникновение меропенема и ванкомицина в СМЖ является низким, в то же время демонстрируя высокую индивидуальную вариабельность. У ряда пациентов не удалось достигнуть целевого уровня концентрации в ликворе. Для оптимизации интратекального введения пациентам с вентрикулитом авторы рекомендуют непрерывную инфузию антибиотика до достижения целевых концентраций в сыворотке 20–30 мг/л для ванкомицина и 16–32 мг/л для меропенема [33]. В последнем исследовании Zhang с соавт. (2019) авторы приводят аргументы, подтверждающие эффективность и безопасность интратекального введения меропенема и ванкомицина [34]. Некоторые исследования демонстрируют, что внутрижелудочковое или интратекальное введение АБП (например, полимиксина В, колистиметата натрия, гентамицина и ванкомицина) не связано с тяжелой или необратимой токсичностью [35]. При туберкулезном менингите возможно интратекальное введение изониазида (до 2,5 мг/кг), хотя в реальной клинической практике это встречается редко [22].
В консенсусном руководстве Британского общества по внутрижелудочковому применению антибактериальных препаратов для лечения нейрохирургических инфекций (2000) было рекомендовано подбирать начальную дозу ванкомицина и гентамицина на основании верифицированного при нейровизуализации объема желудочков:
- щелевидные желудочки: 5 мг ванкомицина и 2 мг гентамицина;
- нормальный размер: 10 мг ванкомицина и 3 мг гентамицина;
- увеличенные желудочки: 15–20 мг ванкомицина и 4–5 мг гентамицина.
Также кратность введения АБП предлагалось корригировать на основании количества СМЖ, полученного из вентрикулярного дренажа за предыдущие сутки. При сбросе ликвора, не превышающем 50 мл/сутки, рекомендовалось вводить АБП интравентрикулярно каждый третий день; от 100 до 150 мл — один раз в день. При количестве СМЖ 150–200 мл/сутки предлагалось увеличить дозу ванкомицина на 5 мг, гентамицина — на 1 мг и вводить препараты один раз в день. При сбросе 200–250 мл/сутки дозу ванкомицина увеличивали на 10 мг, гентамицина — на 2 мг один раз в день. Однако данные рекомендации, основанные исключительно на мнении экспертов, не были подтверждены в клинических исследованиях [36].
Имеется и не столь позитивный опыт данного метода введения АБП. Так, у детей с грамотрицательным менингитом и вентрикулитом рутинное интратекальное введение аминогликозидов в дополнение к внутривенным антибиотикам приводило к увеличению смертности в 3 раза по сравнению со стандартным лечением только системными препаратами [37, 38]. По этой причине внутрижелудочковое введение антибиотиков не должно использоваться в случае, когда доступна эффективная системная терапия. До сих пор является предметом споров целесообразность лечения инфекций ЦНС с помощью интратекального введения препаратов. Общепринятым считается использование данной методики при наличии мультирезистентной флоры, когда другие варианты лечения оказались неэффективны. Разрешенные к введению препараты перечислены в табл. 2. В случае применения других АБП врач должен ознакомиться с литературными данными о безопасности используемой группы антибиотиков при непосредственном введении в ликвор. Если данные отсутствуют, необходимо убедиться, что рН и осмолярность раствора совместимы с интратекальным введением.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Горбачев В.И., Брагина Н.В. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.